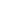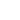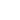Influence of fixing methods on structural and morphological parameters of human blood cells
Пример применений 078 (pdf 360 Kb)
Gushina J.Yu., Pleskova S.N.
Research and Educational Center of Solid State Nanostructures
University of Nizhny Novgorod
INTRODUCTION
The investigation of biological objects, in particular, cells by scanning probe microscopy (SPM) demands a special preparing of biological object. This preparing means the fixation of the biological object. The fixing is applied to kill the cell and to keep it form at the certain stage of development or change by external influence. As a clamp spirits and aldehyde: methanol, ethanol, glutaraldehyde and etc. are used.
At the same time with the use of SPM of special designs (with different liquid cells) researches of living biological samples, without fixing are carried out.
Both those and other SPM techniques of cells researches possess of the certain advantages and disadvantages.
The objectives was to investigate the morphological parameters of the fixed blood cells with most known of used methods of fixing for carrying out the SPM measurements and of the living cells with their natural adhesion to a substrate, and also to compare the results to find the optimal method for biological sample SPM investigation.
The object of investigation was human blood cells - polymorphonuclear neutrophils (PMN). For fixing of cells the methanol and glutaraldehyde was used.
SAMPLES PREPARATIONS
The object of investigation from venous blood of healthy volunteers. Erythrocytes were lysed with ice-cold isotonic NH4CL solution for 12 min, 00 С. The remaining granulocytes were washed with PBS and resuspended in HBSS at a concentration of 2.106 cells/ml. Then, 0.05 ml cells from each test were placed on (glass) slides. Neutrophils become spontaneously adherent.
Cells fixing. After cell deposition and adhesion on the slide (30 min, 24°C) cells were fixed with:
1. methanol (0.05 ml, 10 min)
2. glutaraldehyde (0.05 ml, 20 min).
Smears were washed by distilled water and dried in the air.
METHOD OF INVESTIGATION
The cells morphology was investigated by SPM (Solver Bio NT‑MDT SI, Russia).
Investigations of fixing cells on air: the contact mode for investigate the PMN on air was chosen. In some cases (especially with the glutaraldehyde fixation) we observed the catching of biological sample by SPM-probe because of lateral force. To minimize this effect the scan rate was selected at the level of 0,5-1 line/sec.
We used a contact Si probe CSG11 (NT‑MDT SI) with spring constant 0,03 N/m, curvature radius of tip 10 nm, and tip height 10-20 mkm.
The investigation of fixing cells was not difficult. About 30 cells were scans on air.
Investigations of living cells on liquid: When we are scanning the living cells it is necessary, that they have been adhesion on a surface of glass very well. As we worked with neutrophils without fixing preparations (f.e. polilisin) we used buffer solution of Henks, because it contains ions of calcium, and adhesion is calcium-dependent mechanism.
In noncontact mode about 20 living cells were investigated.
We used contact Si probe CSG11 (NT‑MDT SI) with spring constant 0,03 N/m, curvature radius of tip 50-60 nm, and tip height 10-20 mkm. Resonant frequency was selected within15-40 KHz. Scan rate in this method was about 2 line/sec. Decrease of the scan rate led to more mechanical damage of sample by silicon probe.
Statistic analysis was made in Origin 5,0 Server.
Special preparation of the probes for investigation in liquid. Contact Si probe CSG11 was preliminary rebated by scanning the Si sample. The cantilever deflection value was 3-5 times more than during researches with standard contact mode.
Results of investigations
During the investigations of living cells we observed the boundary of cell, nucleus and inclusion granules of cytoplasm. The clearly segmented nucleus was especially well seen on lateral profile of the cell there the small ledge is a granule of cytoplasm and two big ledges are cell nucleus (Fig.1).
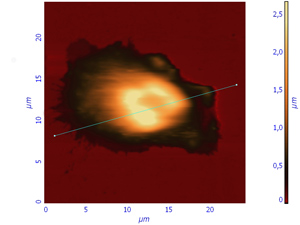
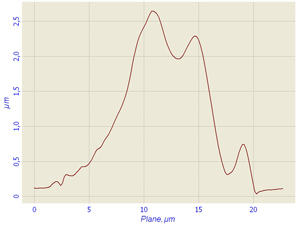
Fig.1 Living polymorphonuclear neutrophils and profile of living cells in liquid obtained in semicontact mode with contact Si probes CSG 11. Scan rate about 2 line/sec
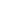
Also we observed the neutrophils where the nucleus was defined badly, however could be revealed using profile of the cell. Cells had the round form. In this case only adhesion of a cell to a glass surface, but not it spreading was observed only. Practically all cytoplasm appears concentrated near a nucleus. That decreases the resolution of a cell. Granules of cytoplasm are not identified practically. The cell has a rough surface that also could be seen on cell profile (Fig.2).

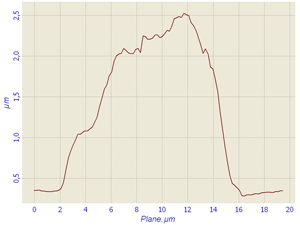
Fig.2 Living polymorphonuclear neutrophils and profile of living cell in liquid obtained in semicontact mode with contact Si probes CSG 11. Scan rate about 2 line/sec
During the investigations of cells fixed by methanol the boundary of cells, granules of cytoplasm and nucleus are defined clearly. The cell fixed by methanol practically loses the water and completely spreading on a substrate. It sharply changes the morphological parameters of a cell.
The resolution of scanning probe microscope is higher for "hard" fixed biological objects on air than for "soft" living cells.

Fig.3 Polymorphonuclear neutrophils fixed by methanol on air obtained in contact mode with contact Si probes CSG 11. Scan rate about 1 line/sec
During the investigations of sells fixed by glutaraldehyde we not found advantages of this method of fixing, though the fixing by glutaraldehyde is a conventional method for SPM researches of biological preparations [2, 3]. As the cell fixed by glutaraldehyde keeps water and not spreads on a substrate, its image is identical to the living neutrophils image, there the borders of cells are observed well. However a nucleus and granules are not identified (Fig. 4). The roughness of a cell which practically is not appeared at fixing by methanol is appreciable only. The sizes of cells fixed by glutaraldehyde are differing from living cells and cells fixed by methanol.

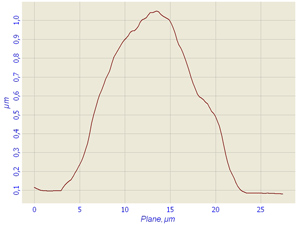
Fig.4 Polymorphonuclear neutrophils fixed by glutaraldehyde on air obtained in contact mode with contact Si probes CSG 11. Scan rate about 0,5 line/sec
Statistic analysis was show that height and lateral size of living cells are considerably and authentically differ from the fixed analogues.
Morphological parameters of the polymorphonuclear neutrophils
| The living cells | Cells were fixed with methanol | Cells were fixed with glutaraldehyde | |
| Lateral size of the cells (mkm) | 14,55 ± 0,55* | 16,72 ± 0,41* | 18,25 ± 0,48* |
| Height of the cells (mkm) | 2,133 ± 0,112** | 0,664 ± 0,026** | 1,031 ± 0,049** |
*F=15,11(= 138,1; = 9,136;) p<0,001>
*F=99,26(= 214,1; = 2,15;) p<0,001>
CONCLUSION
The cells sizes were changed by any fixing method: fixing by methanol changes the cells height and fixing by glutaraldehyde changes the lateral size of the cells generally.
But using the fixations has some advantage compared to living cells:
(1) Long storage and repeated research of a sample through the certain time intervals;
(2) Transportation possibility;
(3) High lateral resolution for detail cells investigation.
Therefore for research of the different cell processes and morphological changes, accompanying these processes it is more convenient to use investigation in a liquid environment of living samples. And for visualization of small details of changes (especially, nucleus and inclusion granules of cytoplasm) it is better to use methods of fixing by methanol.
REFERENCES
1. Podosinnikov I.V., Nilova L.G.,Babitchenko I.V.// Laboratory diagnostic, 1981. №8. с. 68 .
2. Beckmann M., Kolb H.A., Lang F. Atomic force microscopy of peritoneal macrophages after particle phagocytosis//Membrane Biology, 1994, V.140, p. 197 - 204
3. Dufrene Y.F. Application of atomic force microscopy to microbial surfaces: from reconstituted cell surface layers to living cells. Micron, 2001, V.32, p. 153 - 165.