Визуализации биологических образцов в жидкой среде
Пример применений 080 (pdf 930 Kb)
Tibor Füzik, Pavel Ulbrich, Tomas Ruml
Institute of Chemical Technology Prague, Department of Biochemistry and Microbiology,
Technicka 5, Prague, Czech Republic, 166 28
Рассмотрены возможности визуализации биологических материалов с помощью атомно-силовой микроскопии (АСМ) в жидкой среде. За последние годы АСМ хорошо зарекомендовала себя в задачах визуализации “мягких” материалов (при условии их предварительной подготовки), с которыми редко удается справиться другими методами. Атомно-силовая микроскопия расширяет возможности получения информации о биологических материалах, потому что она позволяет проводить исследования живых клеток, бактерий и вирусов в окружении, состав которого близок к природным условиям..
ВВЕДЕНИЕ
Этот выпуск “Примеров применений” посвящен исследованию биологических образцов в жидкости. Ниже будут рассмотрены вопросы правильного выбора зонда, режима сканирования и настройки кантилевера для работы с использованием полуконтактного (амплитудно-модуляционного) метода, а также необходимые условия для проведения измерений в жидкости. Предложенные рекомендации можно использовать и при работе с образцами небиологической природы. Во второй части статьи показаны возможности АСМ для визуализации биологических образцов, находящихся в жидкой среде.
КОНТАКТНЫЙ И ПОЛУКОНТАКТНЫЙ МЕТОДЫ АСМ
Чаще всего АСМ визуализация биологических образцов в жидкости производится с помощью контактного и полуконтактного методов. Сканирование в контактном методе во многом схоже с измерениями в газовой среде, однако для получения хороших результатов в полуконтактном методе могут потребоваться дополнительные операции. Контактный метод используется, главным образом, для исследования прочных объектов, хорошо закрепленных на подложке, или деталей структуры, расположенной под мягким слоем, которые можно выявить в этом методе. Однако для биологических образцов гораздо лучше подходит полуконтактный метод, в котором не происходит повреждение структуры этих объектов, отличающихся хрупкостью и малой твердостью.
На сегодняшний день сканирование может проводиться либо перемещением зонда, либо перемещением образца. В ряде случаев (образец нельзя закрепить на сканере или используется комбинация АСМ и оптического микроскопа) сканирование зондом оказывается единственной возможностью для проведения измерений. Этот способ позволяет исследовать широкий спектр образцов и несущих поверхностей (например, культура в чашке Петри), которые имеют достаточно большие поперечные размеры. Обычно сканирование зондом приводит к заметному возмущению среды окружения образца, что не позволяет добиться высокого разрешения. Однако если не требуется высокое разрешение и температурная стабильность, зачастую результаты сканирования зондом оказываются вполне удовлетворительными.
Для микроскопии высокого разрешения более предпочтительно сканирование образцом. В этом случае держатель с зондом остается неподвижным, а сканирование обеспечивается перемещением сканера, на котором закреплен образец. Конструкция жидкостной ячейки, закрепляемой на сканере, минимизирует смещения образца относительно ячейки и обеспечивает температурную стабильность. Особенности структуры жидкостной ячейки ограничивают допустимые размеры образца. Тем не менее, ее конструкция позволяет существенно подавить шумовую компоненту сигнала, что необходимо для микроскопии высокого разрешения.
ЗОНДОВЫЙ ДАТЧИК
Надлежащий выбор зондового датчика для АСМ - ключевой фактор, определяющий качество данных независимо от режима сканирования. Для исследования биологических образцов в жидкости необходимо выбирать зондовый датчик в соответствии с особенностями объекта.
Для измерений в газовой среде чаще всего используются кремниевые зондовые датчики. Они состоят из кремниевого зонда, закрепленного на кремниевом кантилевере. Зонд имеет форму конуса высотой ~10-15 мкм. Радиус кончика зонда обычно не превышает 10. Острота зонда позволяет добиться высокого разрешения при измерениях в газовой среде; однако для измерений в жидкости подобные зондовые датчики не подходят, главным образом, из-за большой жесткости кантилевера. Большое значение упругой постоянной кремниевого кантилевера не позволяет осуществить измерения полуконтактным методом в жидкости.
По этой причине для работы в жидкой среде используются зондовые датчики, состоящие из кантилеверов, изготовленных из нитрида кремния, с пирамидальными зондами, также изготовленными из нитрида кремния. Жесткость кантилеверов из нитрида кремния довольно мала, что позволяет использовать их как в полуконтактном, так и в контактном, методах. Нитрид кремния имеет высокую износостойкость, и зонды из этого материала служат гораздо дольше кремниевых. Однако их характеристики по разрешению ограничиваются малой высотой зонда (~2,5 мкм) и большим радиусом кривизны кончика зонда, который без дополнительной заточки составляет обычно ~20‑60 нм. Последний недостаток устраняется путем использования зондов из нитрида кремния с оксидным кончиком, радиус которого может достигать ~10 нм, обеспечивая высокое разрешение данных.
Еще один тип зондовых датчиков, пригодных для проведения измерений в жидкости, - недавно разработанные датчики из комбинации кремний/ нитрид кремния. Этим датчикам присущи достоинства двух типов датчиков, рассмотренных выше. Кантилевер такого зондового датчика изготавливается из нитрида кремния, а зонд - из кремния. Номинальный радиус кривизны кончика зонда - менее 10 нм, что гарантирует достижение высокого разрешения.
НАСТРОЙКА КАНТИЛЕВЕРА ДЛЯ РАБОТЫ В ПОЛУКОНТАКТНОМ РЕЖИМЕ
Для использования полуконтактного метода в жидкости необходимо прежде всего правильно выбрать сигнал обратной связи. В этом случае лучше всего использовать усредненный сигнал RMS с фотодетектора, поскольку он меньше подвержен шумам, чем сигнал амплитуды, поступающий от синхронного детектора (см. Рис. 1). Для точной настройки уровня рабочей точки можно использовать усиление сигнала RMS с помощью предусилителя x10.
Кроме того, для приведения кантилевера в резонанс при работе в жидкости необходимо использовать высокие возбуждающие напряжения (в диапазоне от 1 до 10 В). Недостаточное напряжение не позволяет правильно настроить систему, поэтому рекомендуется использовать максимально допустимое значение. После настройки резонанса это напряжение можно при необходимости понизить, чтобы получить нужную амплитуду колебаний.
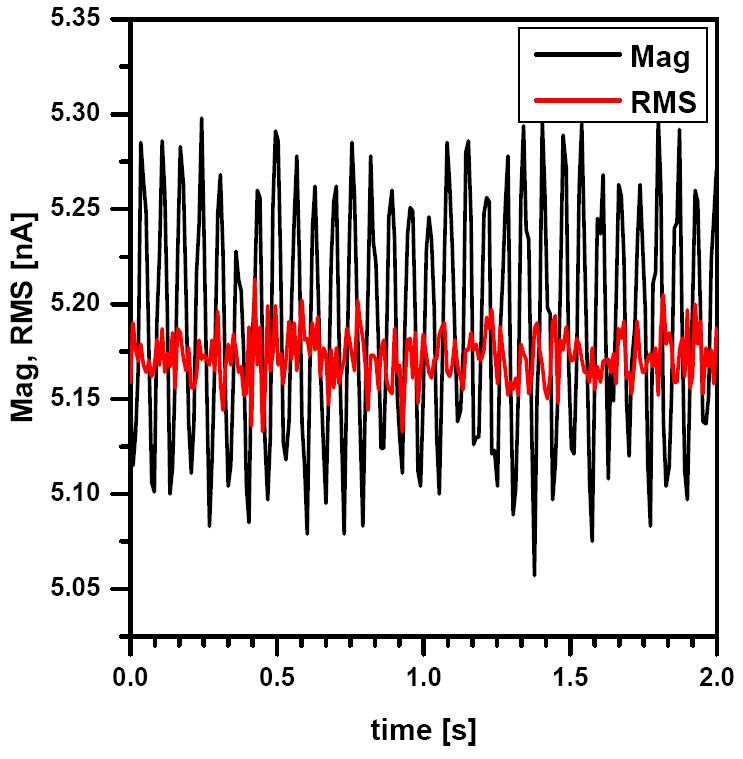
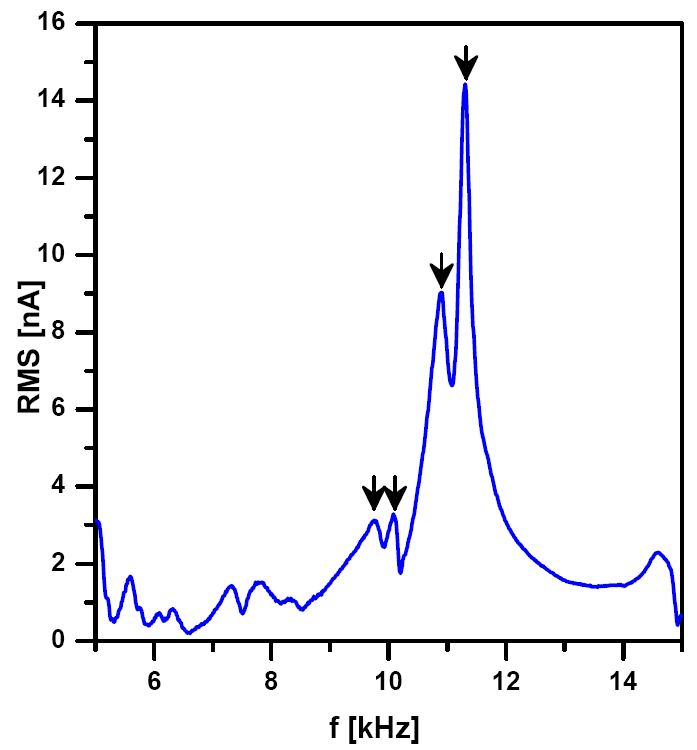
Резонансная частота колебаний кантилевера в жидкости обычно на порядок меньше, чем в случае колебаний в газовой среде, и составляет менее 20 кГц. Не рекомендуется проводить настройку резонанса в жидкости с помощью автоматической процедуры: в отличие от газовой среды, в этом случае резонансная кривая может содержать несколько пиков (см. Рис. 2). Это показывает пример амплитудно-частотной характеристики кантилевера для диапазона 5-20 кГц, показанный на рисунке. Следует отметить, что резонансная частота колебаний кантилевера в жидкости зависит как от характеристик зонда, так и от свойств жидкости. Выбор подходящего резонансного пика может вызвать затруднения, в ряде случаев рациональных аргументов для этого оказывается недостаточно. Тем не менее, следует придерживаться следующих рекомендаций:
- выбирать пик, амплитуда которого превышает амплитуды большинства остальных пиков (хотя он может оказаться неоптимальным);
- после приведения зонда в контакт с образцом следует проверить, уменьшается ли высота резонансного пика при контакте с образцом;
- если для одного из кантилеверов оптимальный пик найден, то обычно соответствующая частота оказывается оптимальной и для других кантилеверов того же типа (при той же конфигурации прибора) - это обстоятельство можно использовать для последующих операций по настройке кантилевера.
ПОДВОД ЗОНДА К ПОВЕРХНОСТИ ОБРАЗЦА, НАХОДЯЩЕГОСЯ В ЖИДКОСТИ
Подвод зонда к поверхности образца, находящегося в жидкости, может вызвать затруднения. Для контактного метода эта процедура мало отличается от случая газовой среды, но для полуконтактного метода возникает ряд осложнений. Начинающим операторам рекомендуется выполнять подвод к поверхности в контактном методом, а затем переключаться на работу полуконтактном методом; однако в ряде случае (мягкие клейкие материалы) это может привести к загрязнению зонда. Во избежание этой проблемы рекомендуется выполнять подвод зонда к поверхности образца полуконтактным методом.
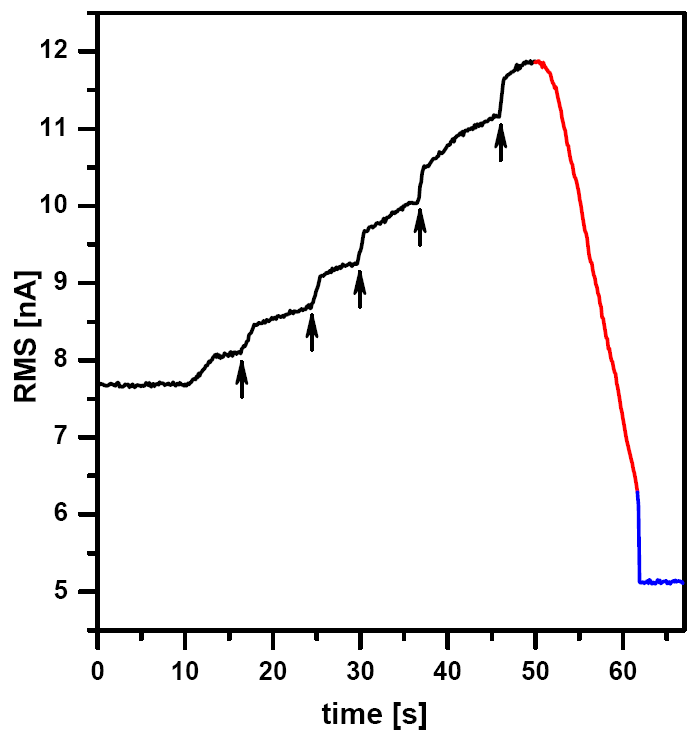
Процедуры подвода в полуконтактном и контактном методах отличаются друг от друга. На начальной стадии подвода амплитуда колебаний кантилевера возрастает, а по мере приближения к образцу она начинает спадать. Это обусловлено влиянием акустических волн в жидкости, которое зависит от расстояния между зондом и образцом. Акустические эффекты приводят к тому, что амплитуда колебаний кантилевера достигает максимума в некоторой окрестности образца, когда контакт зонда с образцом еще не произошел. Дальнейшее сближение приводит к уменьшению амплитуды колебаний, которое, впрочем, недостаточно для проведения измерений. После того, как происходит контакт зонда с образцом, амплитуда колебаний резко падает.
Типичная кривая отклика кантилевера (сигнал RMS) в процессе подвода показана на Рис. 3. На начальной стадии нарастание амплитуды колебаний кантилевера приводит к заметному снижению скорости подвода (контроллер переключается в режим подвода), и поэтому процедуру приходится несколько раз перезапускать (моменты перезапуска отмечены стрелками). Когда кантилевер оказывается достаточно близко от поверхности образца, начинается снижение амплитуды колебаний. До момента контакта с образцом происходит плавное снижение. В конце подвода наблюдается резкое падение амплитуды колебаний до уровня ниже заданной рабочей точки, что означает механический контакт зонда с образцом. Как процедура настройки, так и процедура подвода требует от оператора некоторого практического опыта и хорошего понимания того, как следует задавать уровень рабочей точки и значение коэффициента усиления в контуре обратной связи.
После завершения подвода зонда к образцу рекомендуется выполнить повторную настройку кантилевера, в результате которой значение резонансной частоты может несколько измениться из-за влияния близости поверхности.
АМПЛИТУДА КОЛЕБАНИЙ КАНТИЛЕВЕРА
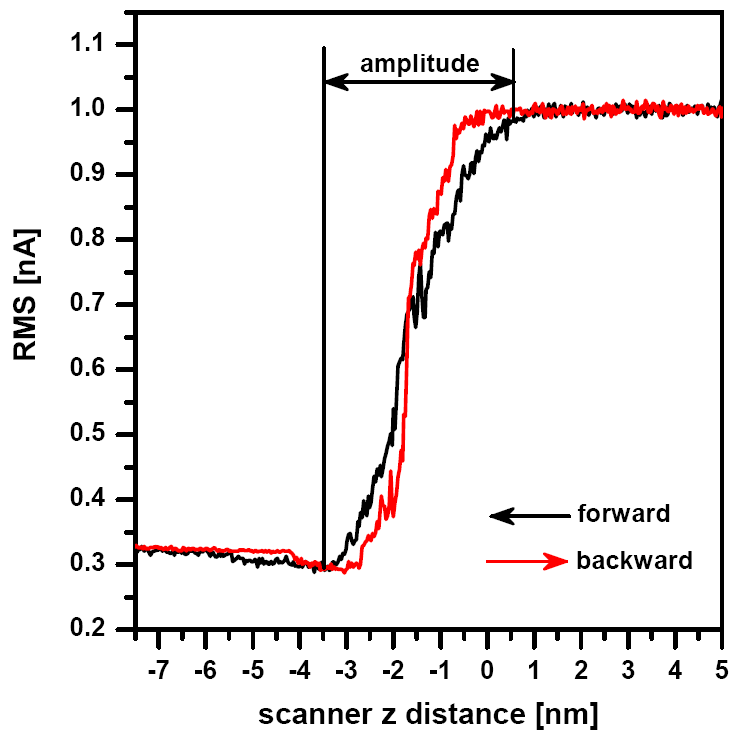
Процедуры проверки амплитуда колебаний кантилевера для газовой и жидкой сред аналогичны. Амплитуда колебаний кантилевера (и, тем самым, силы прижима зонда к образцу) задается выходным напряжением генератора, которое можно настроить с помощью кривой зависимости амплитуды от расстояния между зондом и образцом. По этой же кривой можно оценить качество контакта зонда с образцом.
Если амплитуда остается постоянной при изменении расстояния зонд-образец, контакта между этими частями системы не произошло. Кривые зависимости амплитуда-расстояние для случаев газовой и жидкой сред различаются незначительно (см. Рис. 4).
ПАРАМЕТРЫ ВИЗУАЛИЗАЦИИ ОБРАЗЦА В ЖИДКОЙ СРЕДЕ
Стандартные процедуры настройки параметров сканирования для измерений в жидкой и газовой средах аналогичны. Качество изображений определяется, в первую очередь, параметрами усиления контура обратной связи, уровнем рабочей точки, амплитуды колебаний зондового датчика и скорости сканирования.
Как указывалось выше, нужную амплитуду колебаний кантилевера можно оценить по кривой зависимости амплитуды от расстояния между зондом и образцом. Эта амплитуда зависит от высоты интересующих объектов относительно поверхности образца. Рекомендуется увеличивать амплитуду колебаний при увеличении высоты исследуемых элементов; однако увеличение амплитуды связано с увеличением силы прижима зонда к образцу, что может быть нежелательно в случае биологических образцов, прочность которых невелика. Для сравнительно гладких и стабильных образцов начальное значение амплитуды можно задать на уровне 10-50 нм.
Вероятно, наиболее важными параметрами процесса сканирования являются уровень рабочей точки и усиление обратной связи. Для стабильных образцов со слабой адгезией усиление обратной связи можно задать равным 1, однако в большинстве случаев его оптимальное значение лежит в диапазоне 0,5-0,7. Для ряда образцов приходится задавать намного меньшее значение, однако для малых областей сканирования это обычно не представляет проблем. Наряду с амплитудой колебаний кантилевера сила прижима зонда к образцу определяется также уровнем рабочей точки. Чем ниже этот уровень, тем больше сила прижима. Обычно в начале эксперимента рабочую точку задают на уровне 80-90% амплитуды свободных колебаний. Можно также подобрать рабочую точку, плавно уменьшая ее значение до уровня, при котором регистрируемое изображение не содержит структурных деталей.
Зачастую в ходе измерений для получения стабильного изображения приходится повторно подирать уровень рабочей точки. Это связано с изгибом кантилевера в жидкости. Если существует градиент температур по кантилеверу, в процессе сканирования он будет изгибаться. Это приведет к смещению лазерного пятна относительно центра фотодетектора и уменьшению сигнала по амплитуде колебаний (но не самой амплитуды!) и, следовательно, к необходимости уменьшения уровня рабочей точки, чтобы поддерживать силу прижима на прежнем уровне. Во избежание подобного дрейфа при необходимости высокого разрешения рекомендуется запускать измерения после достаточно длительного времени, в течение которого система должна прийти в состояние термодинамического равновесия.
Оптимальная скорость сканирования зависит не только от времени отклика цепи обратной связи (приводящей к затягиванию фронтов сигналов), но и от адгезии образца. Для некоторых образцов при малых скоростях сканирования происходит прилипание зонда к образцу, которое затрудняет визуализацию. В подобных случаях может помочь увеличение скорости сканирование, возможно, при ухудшении разрешения.
ОСНОВНЫЕ ОПЕРАЦИИ ПО ПОДГОТОВКЕ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ
Вирусы
Ввиду их малых размеров вирусы изучаются в основном методами электронной микроскопии. Однако эти методы редко позволяют исследовать вирус в его исходной форме и часто требуют нежелательного окрашивания и обезвоживания образца. Основное преимущество атомно-силовой микроскопии для таких образцов - возможность проводить измерения в жидкой среде. При таком подходе можно контролировать давление прижима зонда к вирусной частице и зачастую удается визуализировать структуру поверхности образца (см. Рис. 5).
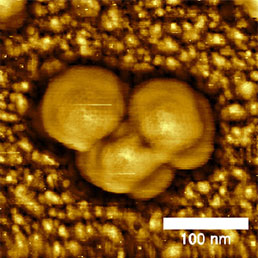
a)

b)
На сегодняшний день опубликованы многие статьи, описывающие сканирование вирусных частиц от самых маленьких (например, риновирусов [1]) до самых больших (гигантский мимивирус [2]). В этих работах исследуется не только поверхностная структура вирусов, процесс кристаллизации вирусных частиц [3, 4], которые часто видны, но и механические свойства [5].
Основная проблема при сканировании вирусных частиц обычно заключается в их прикреплении к поверхности сканирования. Это обычно основано на электростатическом принципе, достигаемом поверхностью с покрытием из полилизина [2, 6] или катионами многовалентного металла [7]. Сообщалось также о прикреплении к силан-модифицированным поверхностям слюды [8] или силан-модифицированным кремниевым пластинам с иммобилизованными антителами [9].
Буферная среда с контролируемой ионной силой и рН может служить не только для получения изображений с высоким разрешением [10], но также для исследования стабильности частиц в дивергентных условиях и для имитации выделения их генома в зависимости от свойств окружающей среды [1].
Бактерии
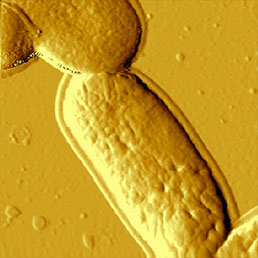
Размеры бактерий на порядок больше размеров вирусных частиц. Простой метод визуализации бактерий - АСМ измерения в газовой среде. Иммобилизацию образца можно проводить путем высушивания суспензии бактерий, осажденной на предметное стекло или поверхность слюды. Таким образом можно получить образцы, достаточно прочные даже для измерений контактным методом, однако полуконтактный метод и в этом случае имеет преимущества - он позволяет регистрировать как амплитуду колебаний, так и их фазу (см. Рис. 6).
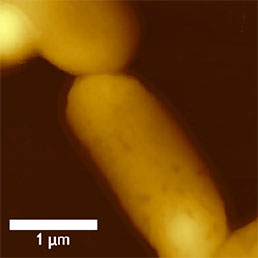
a)
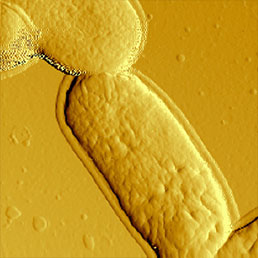
b)
c)
d)
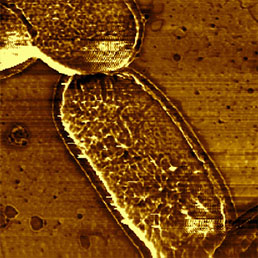
Для иммобилизации бактерий с целью проведения измерений в жидкости должны бать подготовлены специальные подложки. Иммобилизация возможна на поверхности слюды с желатиновым покрытием [11], однако, по-видимому, наиболее доступный путь - использование стеклянной или слюдяной подложки с покрытием из полилизина [12]. Обычно жидкостная среда обеспечивает более высокое разрешение, чем газовая [13], но в случае исследования бактерий это не так. Вероятно, в жидкой среде клеточные стенки бактерий разглаживаются, и поэтому на них труднее найти элементы структуры, чем при измерениях в газовой среде (Рис. 7). Это можно объяснить тем, что в процессе высушивания некоторые части стенок пересыхают и становятся прочнее по сравнению с их естественным состоянием в природной среде, в которой поддерживается динамика частей поверхности бактерии. Кроме того, в изображение вносятся искажения, связанные с артефактами сканирования на резких границах элементов структуры, возникающими из-за конечных размеров зонда [14].
Поскольку АСМ позволяет изучать особенности поверхности бактерий, которой являются клеточные стенки, был проведен исследований, посвященных воздействию антибиотиков на клеточные стенки [15] и обработке стенок лизоцимом [12].

a)

b)
Культуры клеток тканей
Культуры клеток, по-видимому, наиболее крупные биологические объекты, доступные для исследований с помощью АСМ. В поперечном направлении их размеры могут достигать десятков мкм, а в вертикальном направлении - нескольких мкм в зависимости от ориентации клеток. Это один из наиболее мягких материалов для сканирования, поскольку культуры не имеют клеточных стенок, и АСМ зонд соприкасается с незащищенной плазматической мембраной. Ввиду непрочности клеток тканей и других их свойств единственным методом их исследования с помощью АСМ остаются измерений в жидкой среде, позволяющей сохранить их особенности, которые исчезают после высушивания.
Сложность процедуры иммобилизации образца зависит от природы клеточной линии. Адгезивные клеточные линии могут быть иммобилизованы простым выращиванием на поверхности предметного стекла. Для фиксации суспензии клеточных линий можно использовать стеклянную подложку с покрытием из полилизина.
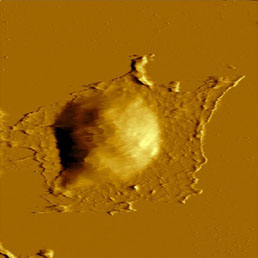
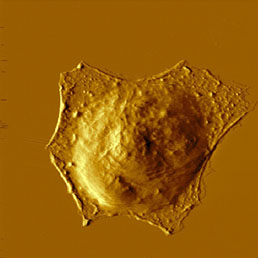
Поскольку клеточная мембрана весьма непрочна, во избежание разрушения мембран при сканировании рекомендуется использовать зонды со сравнительно большим радиусом кривизны кончика (зонды из нитрида кремния без дополнительной заточки). Мягкость мембран позволяет визуализировать не только поверхность клеток, но и цитоскелет, расположенный под мембраной (Рис. 8). Такие изображения можно получить контактным методом при повышенной силе прижима, обеспечивающей визуализацию цитоскелета под мембраной клетки [16], а также полуконтактным методом при пониженной (до 40%) амплитуде свободных колебаний [17].
Для повышения жесткости клеток разработаны специальные методы их фиксации. Чаще всего используется фиксация белков с помощью формальдегида или глутаральдегида (см. Рис. 8) и фиксация липидов мембраны с помощью OsO4. Последний метод позволяет упрочнить мембраны настолько, что становится возможной визуализация их поверхностной структуры [18], в то время как без фиксации текучесть и мягкость мембран препятствуют выявлению тонких деталей структуры. Эти детали можно обнаружить как на изображениях рельефа, так и на изображениях по амплитуде, фазе и второй гармонике [19].
С помощью АСМ удается визуализировать отщепление виральных частиц от клеток тканей [18], а также осуществить мониторинг прохождения вируса через мембрану клетки в режиме реального времени [20].

a)
b)

a)
b)
ВЫВОДЫ
Хотя атомно-силовая микроскопия была разработана в основном для изучения поверхностей жестких и четко определенных объектов, в течение времени она стала бесценным инструментом для исследования мягких биологических образцов. В этом примере применений мы кратко описали возможности визуализации биологических объектов, таких как вирусных частиц, бактерий и клеточных культур с использованием атомно-силовой микроскопии в жидкой среде.
ЛИТЕРАТУРА
[1] F. Kienberger, R. Zhu, R. Moser, D. Blaas, and P. Hinterdorfer, \Monitoring RNA Release from Human Rhinovirus by Dynamic Force Microscopy," Journal of Virology, vol. 78, pp. 3203-3209, Mar. 2004.
[2] Y. G. Kuznetsov, C. Xiao, S. Sun, D. Raoult, M. Rossmann, and A. McPherson, \Atomic force microscopy investigation of the giant mimivirus.," Virology, vol. 404, pp. 127-137, May 2010.
[3] Y. Kuznetsov, A. Malkin, R. Lucas, and A. McPherson, \Atomic force microscopy studies of icosahedral virus crystal growth.," Colloids and surfaces. B, Biointerfaces, vol. 19, pp. 333-346, Dec. 2000.
[4] A. J. Malkin, Y. G. Kuznetsov, R. W. Lucas, and A. McPherson, \Surface processes in the crystallization of turnip yellow mosaic virus visualized by atomic force microscopy.," Journal of structural biology, vol. 127, pp. 35{43, Aug. 1999.
[5] M. G. Mateu, \Mechanical properties of viruses analyzed by atomic force microscopy: a virological perspective Virus research, vol. 168, pp. 1-22, Sept. 2012.
[6] Y. G. Kuznetsov, P. Ulbrich, S. Haubova, T. Ruml, and A. McPherson, \Atomic force microscopy investigation of MasonPzer monkey virus and human immunode ciency virus type 1 reassembled particles," Virology, vol. 360, pp. 434-446, Apr. 2007.
[7] F. Kienberger, R. Zhu, R. Moser, C. Rankl, D. Blaas, and P. Hinterdorfer, \Dynamic force microscopy for imaging of viruses under physiological conditions.," Biological procedures online, vol. 6, pp. 120-128, Jan. 2004.
[8] Y. Lyubchenko, P. Oden, D. Lampner, S. Lindsay, and K. Dunker, \Atomic force microscopy of DNA and bacteriophage in air, water and propanol: the role of adhesion forces," Nucleic Acids Research, vol. 21, no. 5, pp. 1117-1123, 1993.
[9] M. Moloney, L. McDonnell, and H. O'Shea, \Immobilisation of Semliki forest virus for atomic force microscopy," Ultramicroscopy, vol. 91, pp. 275-279, May 2002.
[10] D. Muller, D. Fotiadis, S. Scheuring, S. Muller, and A. Engel, \Electrostatically balanced subnanometer imaging of biological specimens by atomic force microscope," Biophysical journal, vol. 76, no. 2, pp. 1101-1111, 1999.
[11] M. J. Doktycz, C. J. Sullivan, P. R. Hoyt, D. a. Pelletier, S. Wu, and D. P. Allison, \AFM imaging of bacteria in liquid media immobilized on gelatin coated mica surfaces.," Ultramicroscopy, vol. 97, no. 1-4, pp. 209-16, 2003.
[12] A. Bolshakova, O. Kiselyova, A. Filonov, O. Frolova, Y. Lyubchenko, and I. Yaminsky, \Comparative studies of bacteria with an atomic force microscopy operating in dierent modes," Ultramicroscopy, vol. 86, pp. 121-128, Jan. 2001.
[13] Y. L. Lyubchenko and L. S. Shlyakhtenko, \Visualization of supercoiled DNA with atomic force microscopy in situ.," Proceedings of the National Academy of Sciences of the United States of America, vol. 94, pp. 496-501, Jan. 1997.
[14] S. B. Velegol, S. Pardi, X. Li, D. Velegol, and B. E. Logan, \AFM Imaging Artifacts due to Bacterial Cell Height and AFM Tip Geometry," Langmuir, vol. 19, pp. 851-857, Feb. 2003.
[15] P. C. Braga and D. Ricci, \Atomic force microscopy: application to investigation of Escherichia coli morphology before and after exposure to cefodizime.," Antimicrobial agents and chemotherapy, vol. 42, pp. 18-22, Jan. 1998.
[16] C. Le Grimellec, E. Lesniewska, M. C. Giocondi, E. Finot, V. Vie, and J. P. Goudonnet, \Imaging of the surface of living cells by low-force contactmode atomic force microscopy.," Biophysical journal, vol. 75, pp. 695-703, Aug. 1998.
[17] F. Kienberger, C. Stroh, G. Kada, R. Moser, W. Baumgartner, V. Pastushenko, C. Rankl, U. Schmidt, H. Muller, E. Orlova, C. LeGrimellec, D. Drenckhahn, D. Blaas, and P. Hinterdorfer, \Dynamic force microscopy imaging of native membranes.," Ultramicroscopy, vol. 97, no. 1-4, pp. 229-37, 2003.
[18] Y. G. Kuznetsov, J. G. Victoria, W. E. Robinson, and A. McPherson, \Atomic force microscopy investigation of human immunodeciency virus (HIV) and HIVinfected lymphocytes.," Journal of virology, vol. 77, pp. 11896-909, Nov. 2003.
[19] A. Dulebo, J. Preiner, F. Kienberger, G. Kada, C. Rankl, L. Chtcheglova, C. Lamprecht, D. Kaftan, and P. Hinterdorfer, \Second harmonic atomic force microscopy imaging of live and xed mammalian cells.," Ultramicroscopy, vol. 109, pp. 1056-60, July 2009.
[20] M. Gladniko and I. Rousso, \Directly monitoring individual retrovirus budding events using atomic force microscopy.," Biophysical journal, vol. 94, pp. 320-6, Jan. 2008.